|
Nghe Podcast
Getting your Trinity Audio player ready...
|
Ngày nay sự hiểu biết và ứng dụng của xét nghiệm sinh học phân tử trong cuộc sống được mở rộng không ngừng. Điều này được thể hiện rõ nhất trong ngành Y khoa nói chung, và chuyên ngành Ung thư nói riêng. Nhìn chung, khuynh hướng của Y học đi từ mức vĩ mô đến vi mô, từ mức quần thể đến cá thể, từ mức cơ quan đến tế bào – mô, và đạt đến mức phân tử. Sự tiến bộ của ngành sinh học phân tử cho chúng ta góc nhìn mới, sâu sắc và chính hơn xác về phương diện bệnh học, chẩn đoán và điều trị ung thư, vốn vẫn là thử thách lớn cho Y học hiện đại. Tóm lại, xét nghiệm sinh học phân tử đã giúp nhà lâm sàng ung thư cá thể hóa chẩn đoán và điều trị cho mỗi bệnh nhân, nhằm tối ưu hóa hiệu quả mà vẫn tối thiểu hóa độc tính.
1. Từ bất thường bộ gen, bệnh lý ung thư đến xét nghiệm sinh học phân tử
Bản chất của ung thư có thể nói là tình trạng tổn thương bộ gen, dẫn đến rối loạn điều hòa khiến tế bào tăng sinh mất kiểm soát và xâm lấn – di căn xa. Trong trạng thái bình thường, sự tăng trưởng của tế bào – mô được quyết định bởi sự cân bằng giữa 2 hệ thống: tăng sinh và chết theo lập trình. Khi cân bằng này bị mất đi, có thể do hệ thống tăng sinh bị đẩy mạnh, hệ thống chết theo lập trình bị suy giảm hoặc cả 2, thì ung thư sẽ xảy ra.
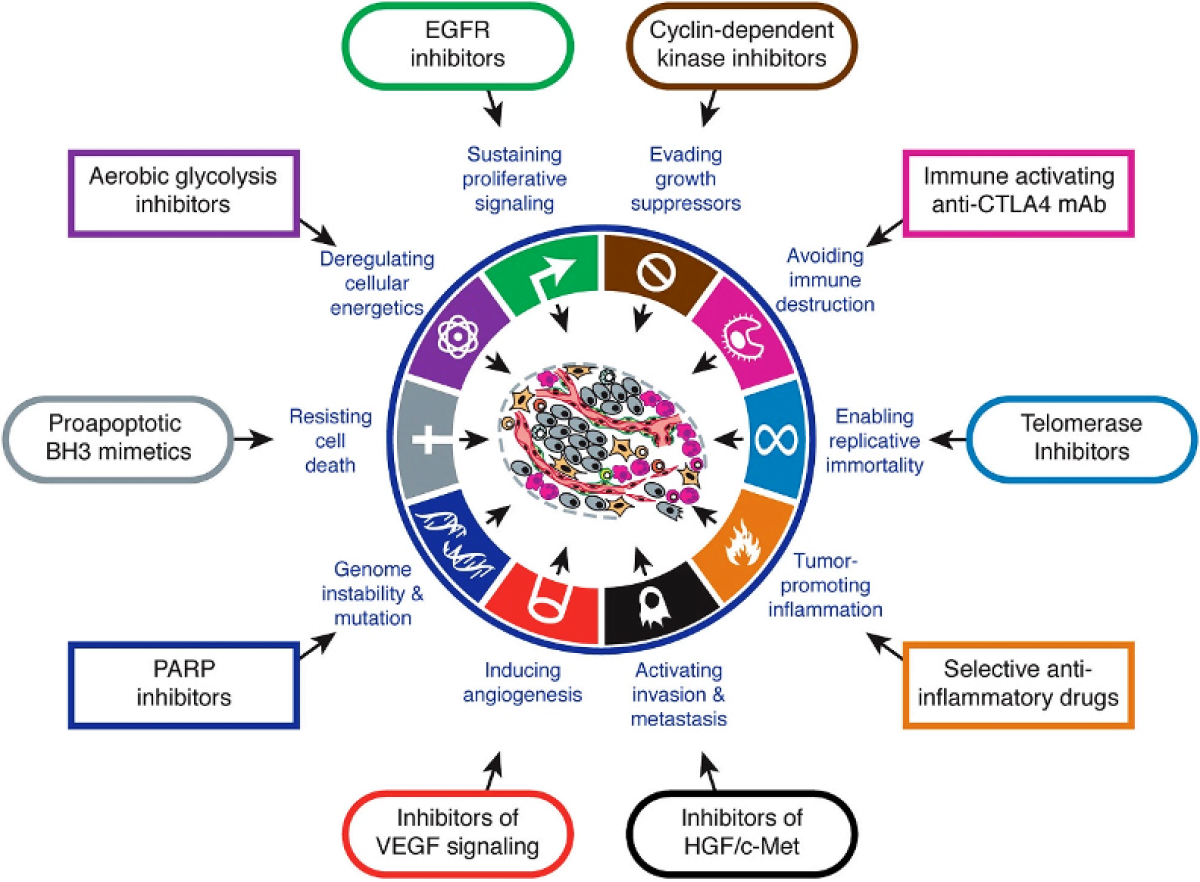
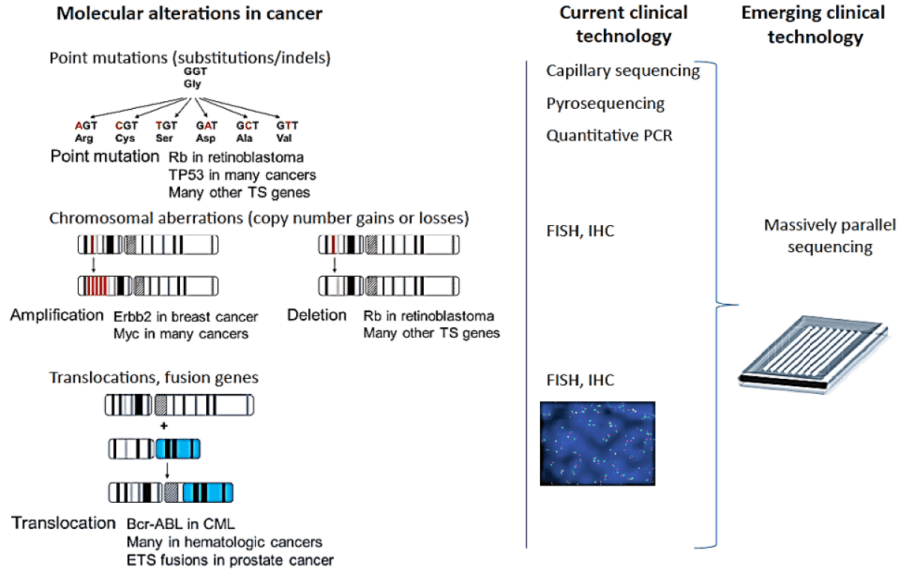
Vì thế, bệnh lý ung thư sẽ không thể được hiểu rõ, cũng như điều trị tốt hơn nếu sự hiểu biết không tiến đến cấp độ phân tử, tức bộ gen. Các xét nghiệm sinh học phân tử đang và sẽ ngày càng giải quyết tốt hơn nhu cầu thiết yếu này, và dường như vai trò hiện tại của nó không thể vắng mặt trong thực hành lâm sàng ung thư. Như minh họa trong hình bên dưới (hình 1), tương ứng với mỗi đột biến/ biến đổi mức phân tử mà có mỗi liệu pháp tương ứng được tìm ra (thường dạng chất đối vận) để khắc chế căn bệnh này.
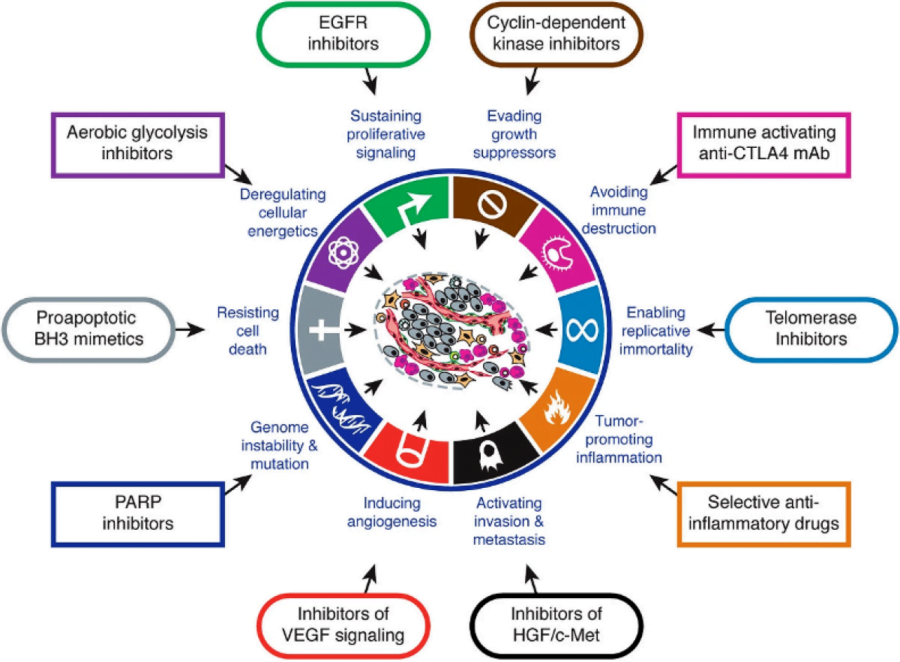
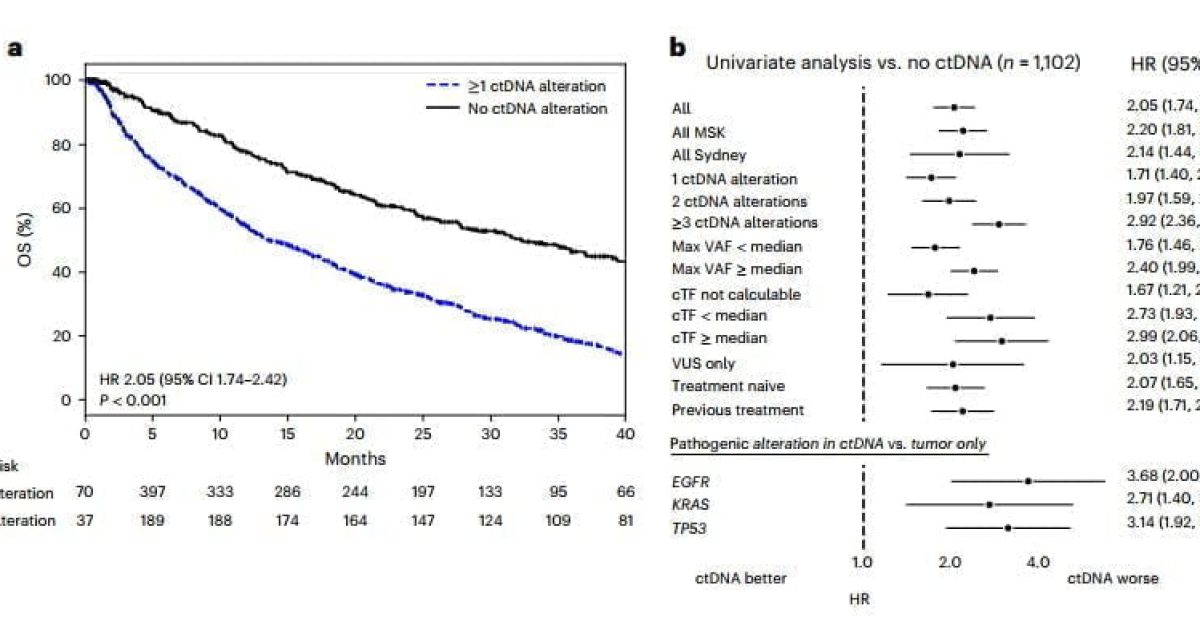
Từ lâu y học cũng ghi nhận sự bất đồng nhất trong đáp ứng điều trị của những bệnh nhân khác nhau với cùng một liệu pháp. Điều này dẫn đến nhiều hệ quả như sự lãng phí về kinh phí điều trị (cá thể kháng trị) và tăng độc tính – tử vong (cá thể nhạy cảm). Tuy nhiên, nhờ xét nghiệm sinh học phân tử mà nhà lâm sàng có thể biết rõ đối tượng nào sẽ hưởng lợi nhất (đáp ứng cao nhất) từ một liệu pháp, cũng như đối tượng nào ít gặp độc tính nhất với một loại thuốc, từ đó đưa ra quyết định chính xác hơn. Đây chính là vai trò cá thể hóa của xét nghiệm sinh học phân tử, được hệ thống trong hình dưới đây (hình 2 – 3).
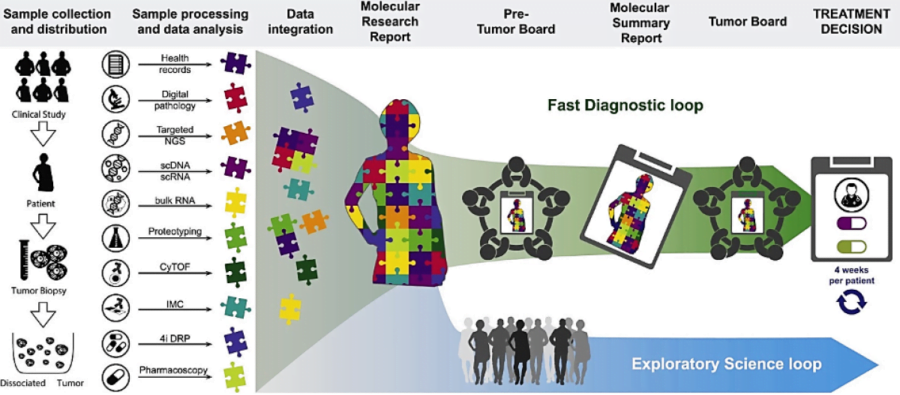
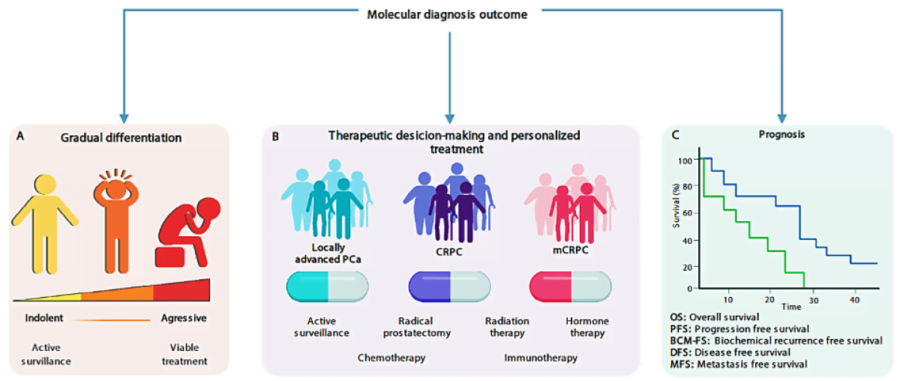
Vì đây là kỹ thuật mới nên tính khả thi có thể bị hạn chế ở nhóm nước kém phát triển, cũng như các bệnh nhân với tài chính eo hẹp. Tuy nhiên, sự bất cập này có thể cải thiện đáng kể theo thời gian và theo chính sách phát triển y tế của mỗi quốc gia. Trên thực tế hiện nay, nhiều đối tượng đã tiếp cận được với xét nghiệm này, so với thập niên trước đây.
2. Nguyên lý xét nghiệm sinh học phân tử
a. Sinh phẩm
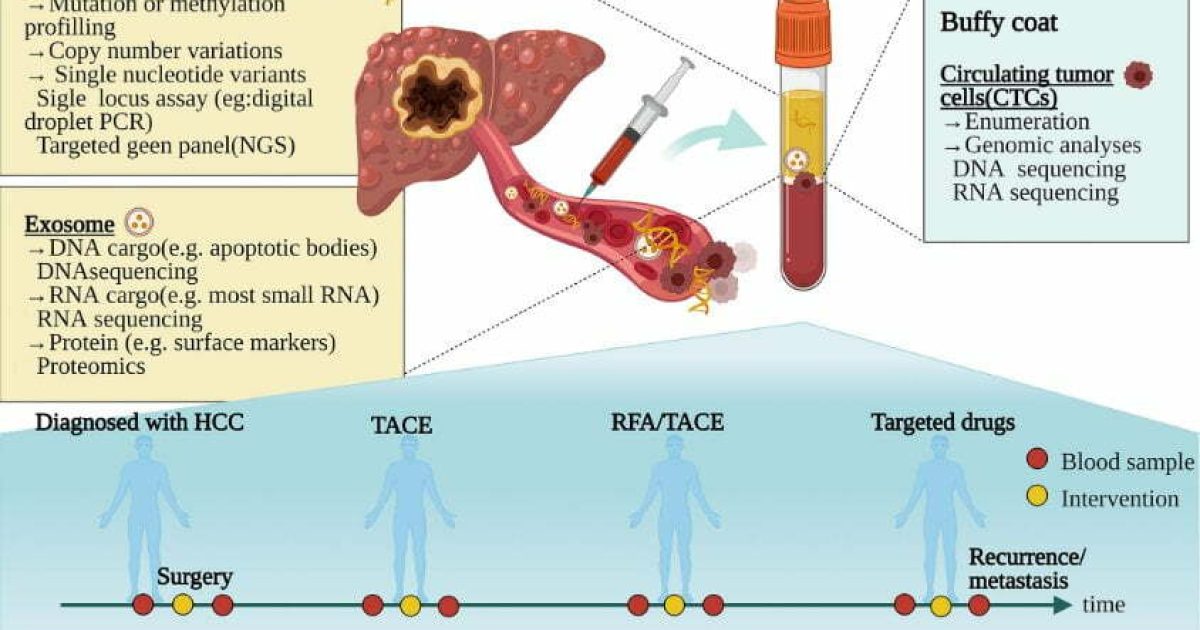
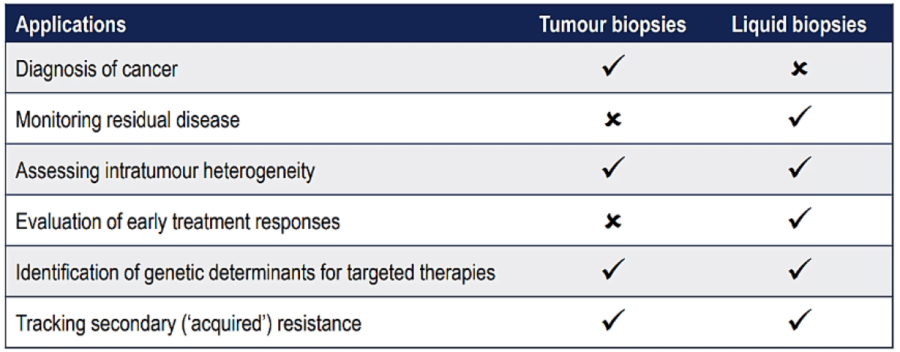
Tùy thuộc vào mục tiêu và kỹ thuật xét nghiệm mà sinh phẩm được chọn sẽ khác nhau. Nhìn chung, sinh phẩm thường là mô đặc hoặc mô lỏng. Mô đặc thường là khối mô bướu được sinh thiết, trong khi mô lỏng thường là dịch cơ thể như: máu, nước tiểu, dịch não tủy, dịch màng phổi, dịch ổ bụng… Ngoài ra, sinh phẩm dạng tươi hay dạng lưu trữ cũng được quan tâm, vì có thể ảnh hưởng đến độ nhạy và độ đặc hiệu của xét nghiệm.

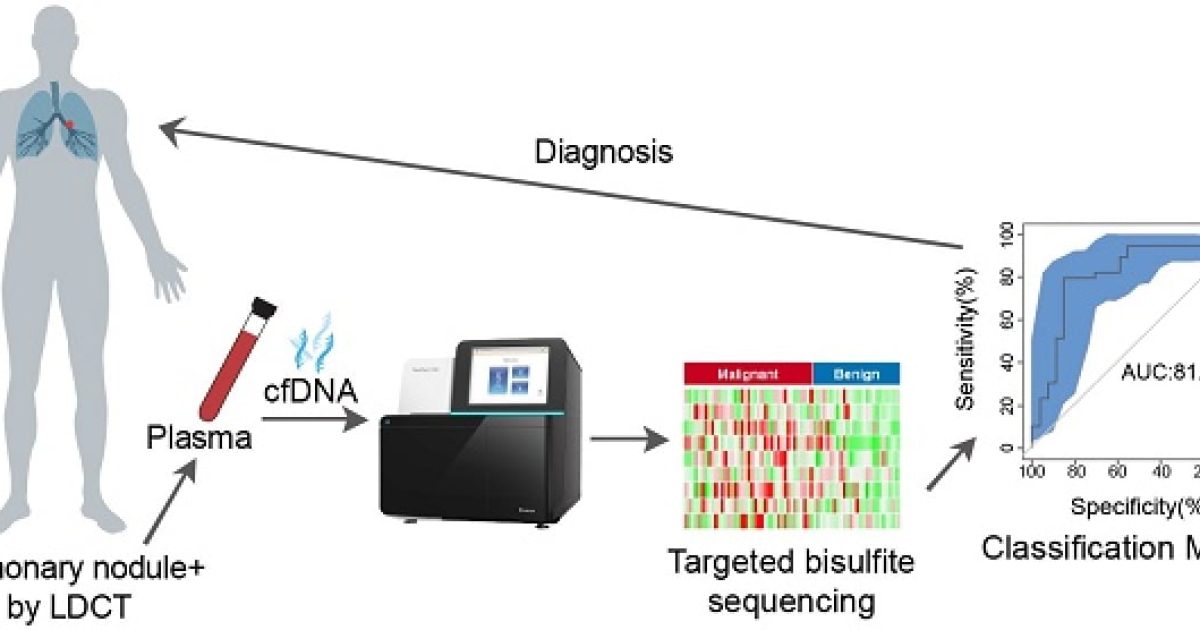
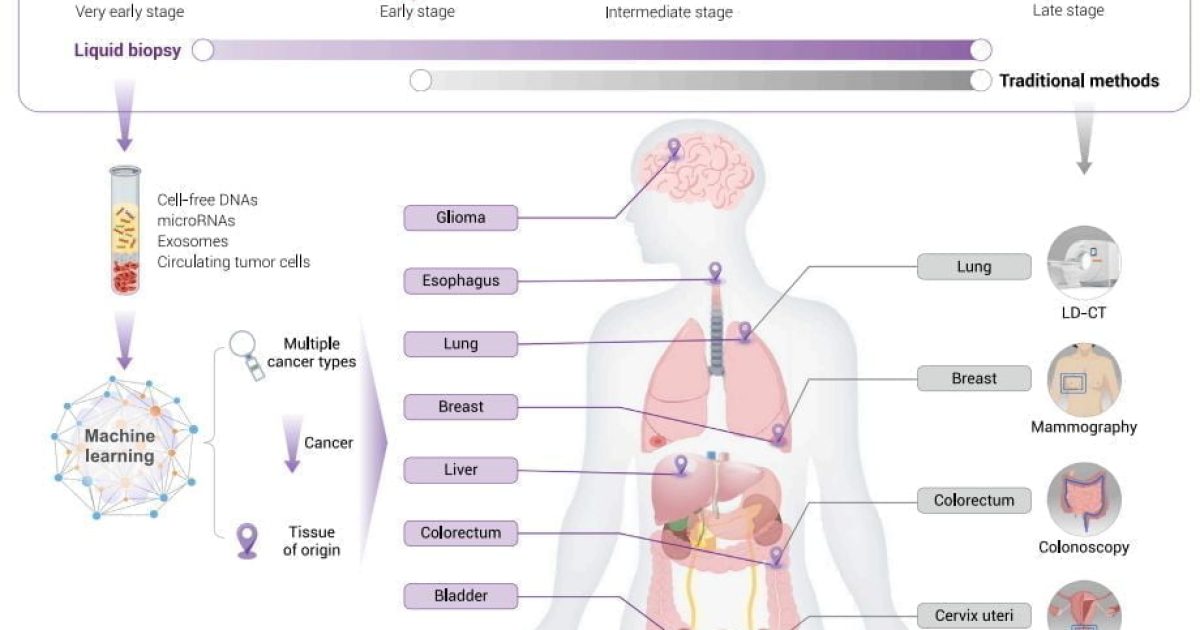
Tiêu chuẩn vàng để chẩn đoán ung thư vẫn dựa trên mô bướu, tuy nhiên chẩn đoán dựa trên mô lỏng (còn gọi là sinh thiết lỏng) ngày càng đóng vai trò quan trọng, đặc biệt trong vài năm gần đây. Sinh thiết lỏng khắc phục nhiều nhược điểm của sinh thiết bướu như: tính xâm lấn, tính lặp lại khả thi, cũng như khả năng mô tả toàn diện đặc tính phân tử khối bướu.
b. Kỹ thuật xét nghiệm phổ biến.
Tùy theo loại biến đổi phân tử trong mỗi loại ung thư mà mỗi kỹ thuật xét nghiệm phù hợp sẽ được ứng dụng nhằm tối ưu hóa hiệu quả, mà giảm tối đa chi phí. Các biến đổi phân tử trong ung thư rất đa dạng, từ đột biến đơn nucleotit, cho đến biến đổi cấp độ nhiễm sắc thể (mất đoạn, dung hợp đoạn…). Nếu như xét nghiệm FISH được ưa thích khi khảo sát dung hợp đoạn, thì xét nghiệm PCR và NGS lại được lựa trong khi khảo sát đột biến gen (đặc biệt là các biến thể di truyền).
Polymerase Chain Reaction – PCR hay phản ứng chuỗi trùng hợp là một kỹ thuật được sử dụng trong sinh học phân tử để tạo ra nhiều bản sao của một đoạn DNA nhất định. Kỹ thuật này được phát triển vào năm 1983 bởi Kary Mullis, một nhà hóa sinh người Mỹ.
In situ hybridization – Lai tại chỗ (ISH) là là kỹ thuật nhằm định vị trình tự axit nucleic quan tâm mà không cần tách chiết ra khỏi mô hay tế bào, cung cấp thông tin về không gian và thời gian gen biểu hiện và locus gen. Fluorescence in situ hybridization – Lai huỳnh quang tại chỗ (FISH) là một kỹ thuật tế bào học phân tử sử dụng các đầu dò huỳnh quang liên kết đặc hiệu với những phần của nhiễm sắc thể; được sử dụng để xác định sự hiện diện và vị trí của một vùng DNA hoặc RNA trên nhiễm sắc thể.
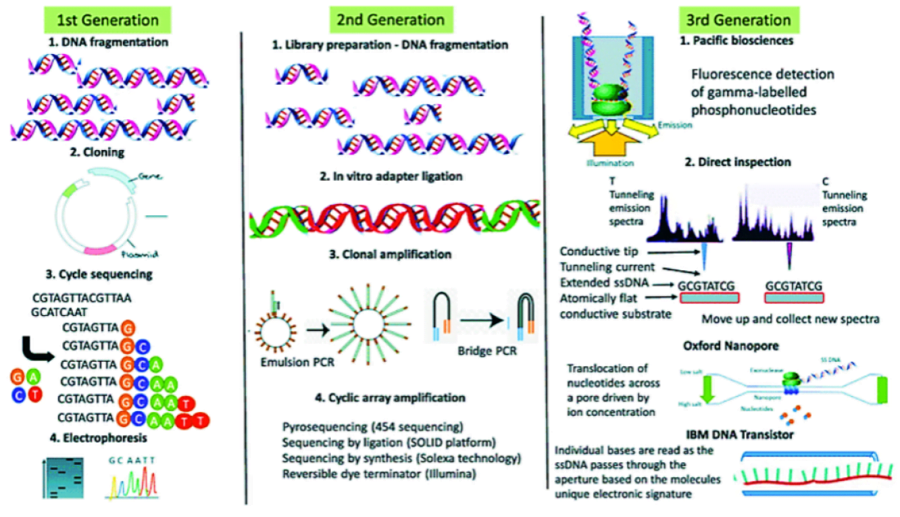
DNA sequencing (Giải trình tự DNA) là kỹ thuật để xác định trình tự của các nucleotide hoặc bazơ trong phân tử DNA. Kỹ thuật giải trình tự DNA có nhiều thế hệ, trong đó loại cổ điển là giải trình tự Sanger, còn Next-Generation Sequencing (NGS) là thế hệ 2 được ứng dụng nhiều trong thời gian qua. Ngoài ra giải trình tự thế hệ 3 khắc phục nhiều nhược điểm của kỹ thuật NGS, được minh họa trong hình bên dưới.
Giải trình tự thế hệ mới (NGS) là công nghệ giải trình tự DNA quy mô lớn cho giải mã toàn bộ bộ gen (whole genome), các exon của các gen đã biết (whole exome) hoặc chỉ các exon của các gen được mục tiêu (target panel). Nhìn chung, NGS được lựa chọn khảo sát cho các tình huống sau:
- Thay đổi trình tự trong toàn bộ bộ gen, exome (DNA)
- Cung cấp thông tin số bản sao DNA
- Giải trình tự toàn bộ hệ thống phiên mã (RNA phiên mã)
- Xác định chuyển vị
- Đánh giá biểu hiện gen
- Sử dụng mẫu mô tươi, mẫu máu hoặc FFPE