|
Nghe Podcast
Getting your Trinity Audio player ready...
|
TỔNG QUAN
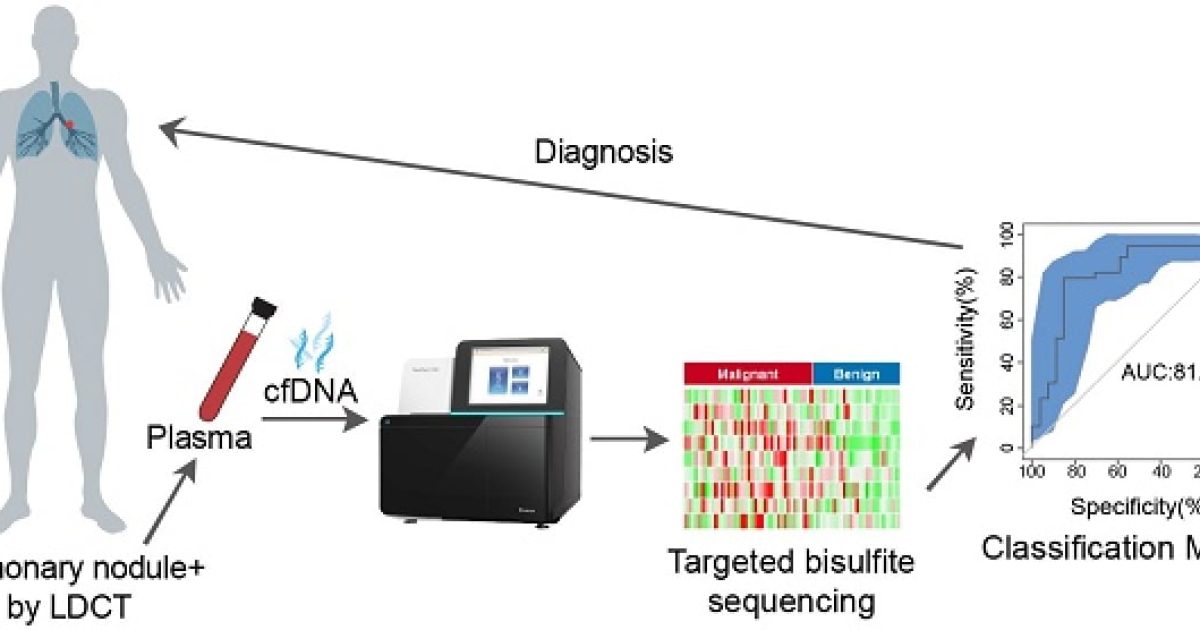
Ung thư biểu mô tế bào gan (HCC) là loại ung thư phổ biến thứ 6 và tử đứng hạng thứ 4 trong các loại ung thư, sẽ có hơn 1 triệu người chết vì HCC vào năm 2030 theo dự đoán của Tổ chức Y tế Thế giới (WHO). Hiện nay, chủ yếu phụ thuộc vào các chất đánh dấu huyết thanh, như alpha-fetoprotein (AFP), kiểm tra hình ảnh cũng như sinh thiết mô để chẩn đoán và xác định tái phát và di căn của HCC sau điều trị. Mặc dù các hướng dẫn thực hành lâm sàng khuyến cáo rằng những người có nguy cơ cao nên được siêu âm (Mỹ) và theo dõi AFP huyết thanh 6 tháng một lần , độ nhạy của phương pháp này để phát hiện HCC giai đoạn đầu chỉ là 63% . Ngoài ra, AFP tăng cao còn có thể gặp ở một số bệnh khác như xơ gan, viêm gan, ung thư đường mật trong gan, ung thư đại tràng di căn. AFP không còn được khuyến cáo là một phần của đánh giá chẩn đoán theo hướng dẫn mới nhất của Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ (AASLD). Là một phương pháp phát hiện không xâm lấn, năng động và có thể lặp lại, “sinh thiết lỏng”, đã thu hút nhiều sự chú ý để chẩn đoán sớm và theo dõi phản ứng điều trị, giúp thúc đẩy sự tiến bộ của y học chính xác
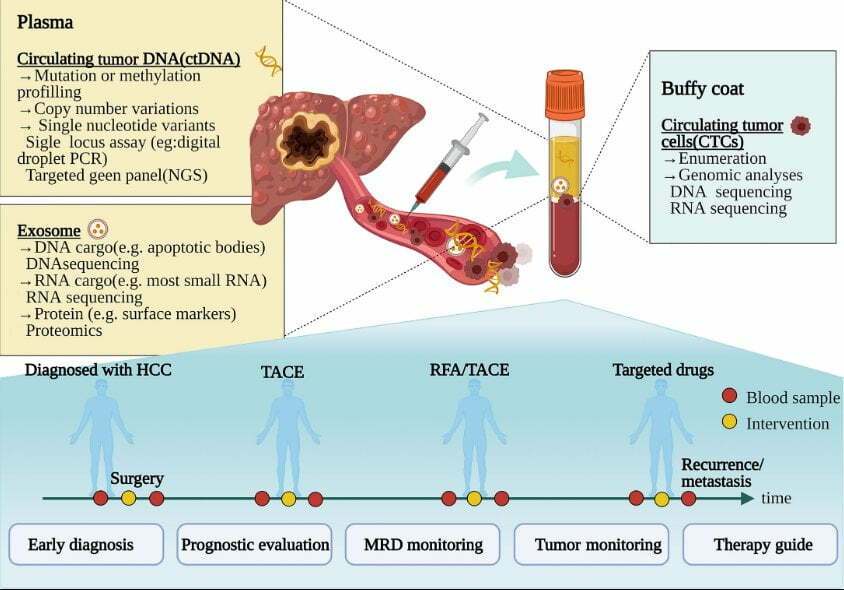
1. ỨNG DỤNG SINH THIẾT LỎNG TRONG HCC
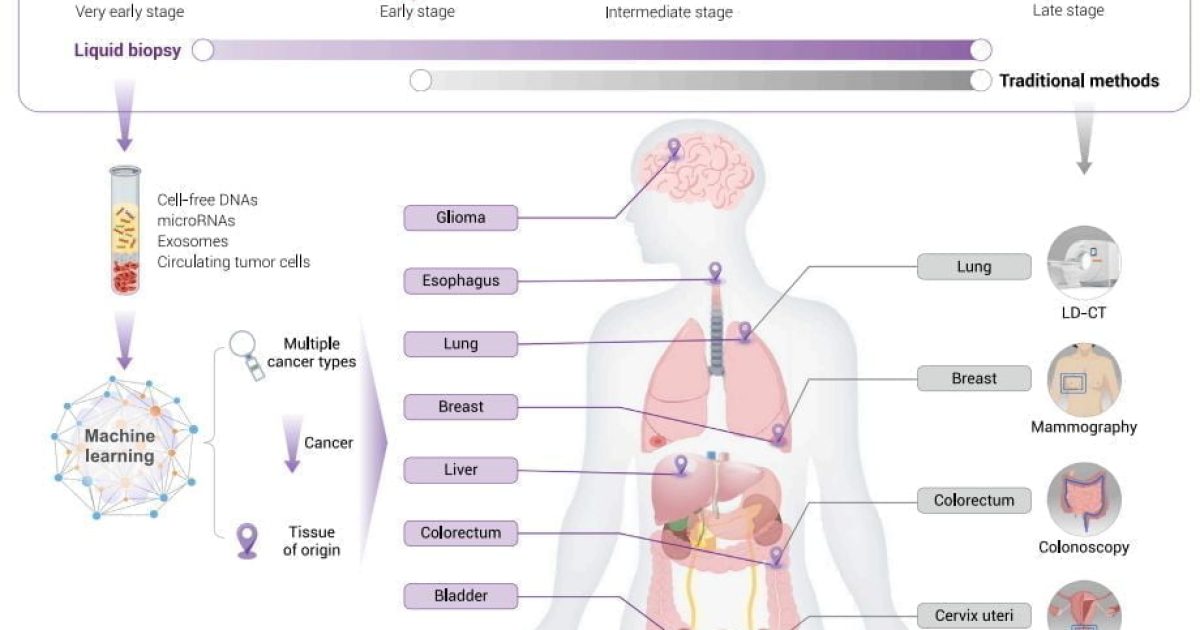
Sinh thiết lỏng thu thập thông tin liên quan đến khối u bằng cách thu thập các mẫu chất lỏng cơ thể như máu và phát hiện các tế bào khối u lưu hành (CTC), DNA lưu hành của khối u (ctDNA) và exosome. Do tính không đồng nhất của HCC, chỉ phụ thuộc vào một lần sinh thiết có thể không đủ để tiết lộ sinh học khối u toàn diện. Trong khi đó, sinh thiết mô cũng không phù hợp để theo dõi sự tiến triển của khối u như một phương pháp thông thường do tính xâm lấn của nó. May mắn thay, sinh thiết lỏng có thể khắc phục những nhược điểm này để cung cấp mẫu bệnh theo thời gian thực theo cách không xâm lấn và thuận tiện. Là dấu ấn sinh học mới, CTC, ctDNA và exosome đã đạt được tiến bộ vượt bậc trong sinh thiết HCC dạng lỏng. Phân tích các đột biến gen cụ thể trong ctDNA sẽ giúp lựa chọn tốt hơn các phương án điều trị và đối phó với tình trạng kháng thuốc. Tổng quan này tóm tắt các ứng dụng lâm sàng của sinh thiết lỏng trong HCC, bao gồm CTC, ctDNA và exosome trong chẩn đoán sớm, đánh giá tiên lượng, theo dõi bệnh và hướng dẫn điều trị cá nhân hóa
TẾ BÀO KHỐI U TUẦN HOÀN TRONG MÁU (CTC)
Các tế bào khối u di chuyển vào máu trở thành CTC bằng cách tiết ra matrix metallicoproteinase để phá vỡ màng đáy. Sau đó, chúng có thể xâm lấn các bộ phận khác nhau của cơ thể thông qua lưu thông máu, do đó được mô tả một cách sinh động là “hạt giống” của các khối u
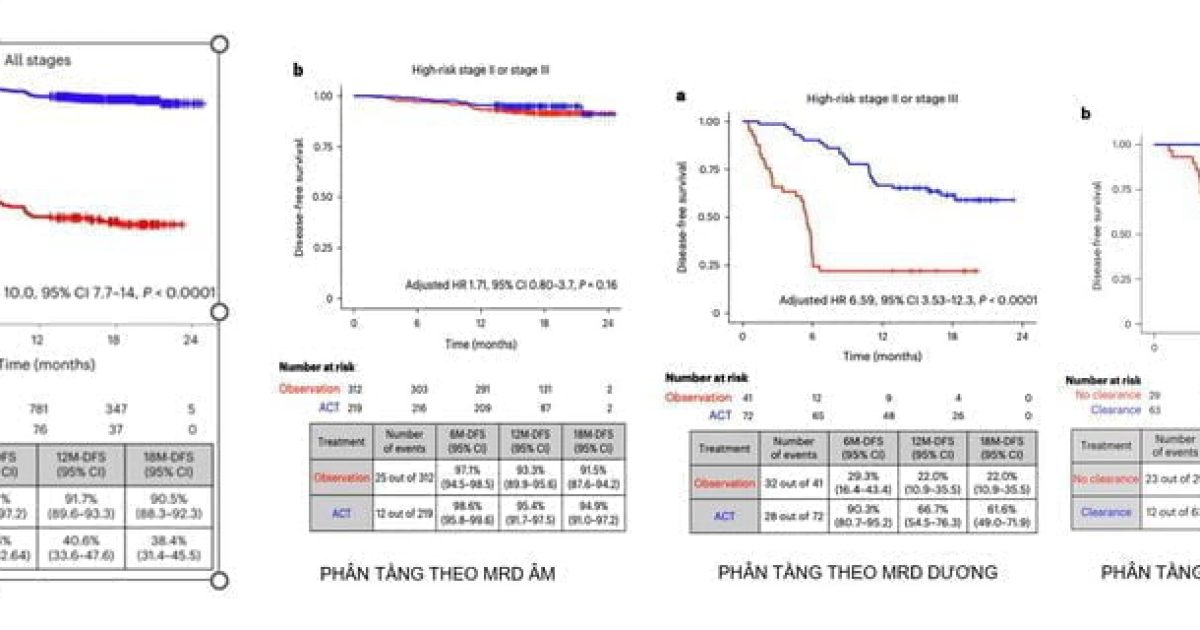
CTC có tác dụng tiên lượng mạnh, đặc biệt sau khi cắt bỏ, nó cũng cho thấy tiềm năng trong việc theo dõi tiến triển của HCC và hướng dẫn điều trị. Nhiều thập kỷ nghiên cứu CTC đã đạt được tiến bộ lớn trong ứng dụng lâm sàng của HCC. Nghiên cứu tiền cứu trên 135 bệnh nhân HCC đã chứng minh rằng phẫu thuật cắt bỏ khối u làm giảm số lượng
CTC có thể đóng vai trò là chỉ số để theo dõi lâu dài HCC và những thay đổi linh hoạt của nó phản ánh đáp ứng điều trị được điều trị bằng các liệu pháp tại chỗ, chẳng hạn như thuyên tắc hóa chất động mạch qua ống thông (TACE), xạ trị và cắt bỏ tần số vô tuyến. Việc xác định các CTC thể hiện các dấu hiệu khối u cụ thể và các mục tiêu thuốc cho phép các bác sĩ hướng dẫn liệu pháp cá nhân hóa tốt hơn
2. ctDNA
Những thay đổi methyl hóa trong ctDNA thường xảy ra sớm trong quá trình sinh ung thư, do đó, việc phát hiện các gen methyl hóa trong ctDNA có tiềm năng lâm sàng nhất định trong HCC. Hơn nữa, ctDNA bao gồm một bộ gen khối u hoàn chỉnh, bao gồm các biến thể có nguồn gốc từ nhiều khối u độc lập, vì vậy ctDNA có lợi thế hơn trong việc khắc phục tính không đồng nhất của khối u so với sinh thiết mô đơn lẻ.
Những thay đổi biểu sinh gây ra bởi quá trình methyl hóa DNA và quá trình methyl hóa DNA có liên quan đến quá trình xuất hiện và phát triển khối u. Mô hình methyl hóa của ctDNA có tiềm năng to lớn trong chẩn đoán sớm bệnh nhân HCC. Kotoh và cộng sự đã phát triển xét nghiệm SEPT9 đã methyl hóa trong HCC, với độ nhạy 63,2% và độ đặc hiệu 90,0%. Họ chỉ ra rằng chẩn đoán kết hợp với AFP có thể cải thiện tỷ lệ chẩn đoán HCC giai đoạn đầu. Hiện tại, Chen et al. đã tiến hành nghiên cứu quy mô lớn, đa trung tâm và xây dựng mô hình chẩn đoán dựa trên phương pháp HIFI (5-Hydroxymethylcytosine/motIf/Fragmentation/nucleosome footprInt), đóng vai trò chính trong việc phân biệt HCC với không phải HCC. Cả bộ thử nghiệm và bộ xác minh đều có độ nhạy và độ đặc hiệu trên 95%
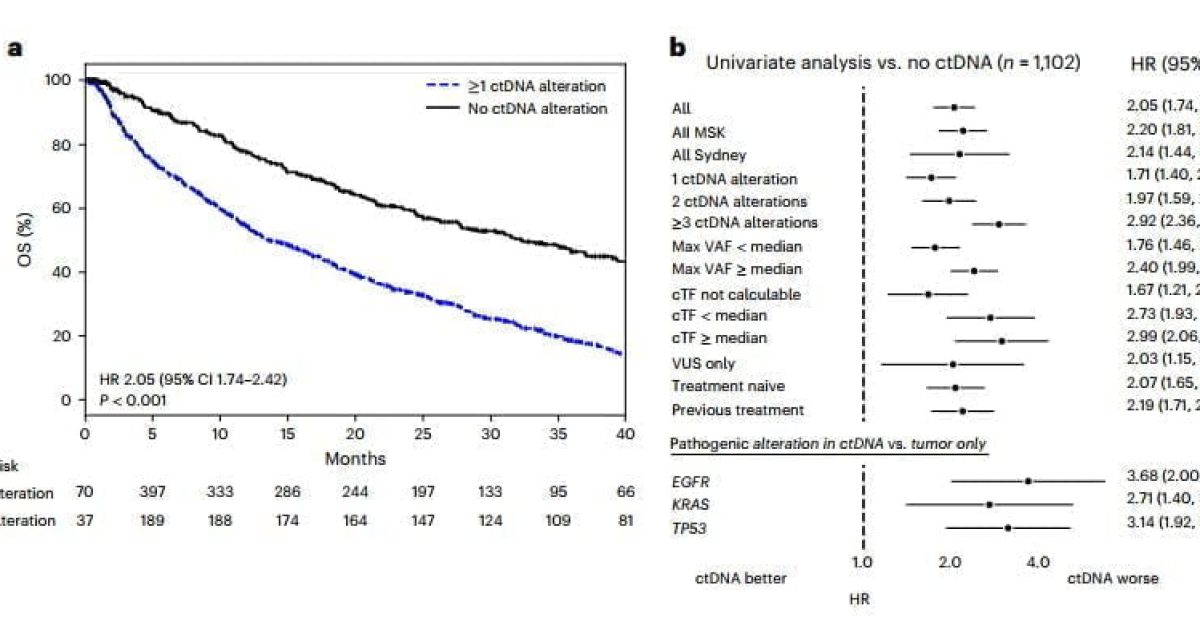
Ngoài vai trò chẩn đoán, quá trình methyl hóa ctDNA cũng có thể được dùng như một chỉ số tiên lượng. Trong một nghiên cứu quy mô lớn liên quan đến 1098 bệnh nhân HCC, một mô hình dự đoán chẩn đoán đã được xây dựng bằng cách sàng lọc 10 dấu hiệu trùng lặp của quá trình methyl hóa cfDNA bằng cách sử dụng các phương pháp Random Forest và Least Absolute Shrinkage and Selection Operator (LASSO). Độ nhạy và độ đặc hiệu chẩn đoán của mô hình này lần lượt là 85,7% và 94,3%
Cuối cùng, ctDNA còn có giá trị trong việc theo dõi khối u và hướng dẫn liệu pháp cá nhân hóa
3. EXOSOME
Exosome được cho là có nguồn gốc từ hồng cầu lưới cừu trưởng thành. Exosome thuộc về các túi ngoại bào (EVs), là một túi màng hai lớp phospholipid có kích thước nano và chịu trách nhiệm liên lạc giữa các tế bào . Nó được tiết ra bởi các tế bào sống và được hình thành do sự phân tách của các túi đa nội bào với màng tế bào trong quá trình giải phóng ra khỏi tế bào. Thành phần được vận chuyển trong exosome chứa một số dấu ấn sinh học phân tử bao gồm protein, RNA, DNA, có kích thước từ 50 đến 140 nm
Tính ổn định sinh học cao của nó giúp cải thiện khả năng ứng dụng lâm sàng của exosome, điều này không chỉ có thể cắt giảm chi phí bảo quản mẫu trong thời gian ngắn mà còn giảm bớt những thách thức trong vận chuyển. Hơn nữa, exosome mang thông tin sinh học từ các tế bào gốc, vì vậy chúng điển hình hơn cfDNA. Exosome gắn liền với sự phát triển và di căn của HCC, sự hình thành khối u, và điều hòa miễn dịch. Exosome có giá trị trong chẩn đoán sớm, đánh giá tiên lượng
KẾT LUẬN
Với sự phong phú liên tục của thông tin khối u phân tử và những đột phá thường xuyên của công nghệ phân tử, ung thư học chính xác đã cách mạng hóa lĩnh vực y học. Sinh thiết lỏng không xâm lấn có lợi thế cạnh tranh để chẩn đoán chính xác và quản lý cá nhân. Việc phát hiện và phân tích CTC, ctDNA và exosome cung cấp một chiến lược đầy hứa hẹn để chẩn đoán sớm, đánh giá tiên lượng, hướng dẫn điều trị và theo dõi MRD và tái phát. Quá trình methyl hóa DNA là một dấu ấn sinh học biểu sinh được sử dụng rộng rãi và việc phân tích quá trình methyl hóa ctDNA có khả năng chẩn đoán sớm những bệnh nhân có nguy cơ cao mắc HCC. Điều này có thể sớm trở thành một phương pháp thay thế để theo dõi lâu dài HCC và là một phương pháp bổ sung cho các phương pháp phát hiện lâm sàng hiện có. Đặc tính phân tử của ctDNA và CTC, ít nhất là một phần, phụ thuộc vào gánh nặng khối u, vì vậy chúng có thể hữu ích hơn ở các cơ sở trung cấp hoặc nâng cao trong tiên lượng hoặc dự đoán đáp ứng điều trị. Nói chung, sự gia tăng mức độ CTC sau khi điều trị cho thấy sự tái phát của khối u và giảm tỷ lệ sống sót. Các nghiên cứu sâu hơn về CTC và ctDNA sẽ hiểu rõ hơn về sự xuất hiện của khả năng kháng sorafenib hoặc TACE. Nó cũng cung cấp những hiểu biết mới về sự phát triển của các chương trình chẩn đoán và điều trị HCC được cá nhân hóa hơn. Các chất trong exosome, đặc biệt là miRNA, cung cấp một hướng mới để cải thiện chẩn đoán sớm HCC. Do đó, sinh thiết lỏng có thể cung cấp cho các nhà nghiên cứu thông tin chi tiết và cá nhân hóa hơn từ chẩn đoán ung thư đến theo dõi khối u bằng cách thu thập mẫu liên tục. Tuy nhiên, vẫn còn những thách thức trong cách chuyển sinh thiết lỏng từ băng ghế sang đầu giường. Ứng dụng lâm sàng của sinh thiết lỏng yêu cầu các dấu ấn sinh học chính xác và các phương pháp phát hiện được tiêu chuẩn hóa. Tóm lại, sinh thiết lỏng dường như là một phương pháp thuận tiện, không xâm lấn và tiềm năng cho HCC.